化学の世界
化学という言葉は江戸時代には舎密(せいみ)と言ったらしい。日本の近代化には不可欠な学問だったんだ。
目次
| 原子の発見 | 無機化学の世界 | 酸化と還元 | 酸と塩基 | ||
| 元素の周期律表 | 炎色反応 | ||||
| 有機化学の世界 | 異性体 | タンパク質とアミノ酸 | 有機分子模型 | 糖類 | 油脂 |
| 細胞とは何か | 水は特別な存在 | 珪素と硫黄の世界 | 窒素とリンの役割 | ||
| 光合成 | Health Effects of Fish Oil | Trans fat | |||
| 触媒 | ビタミン | 酵素 | ホルモン | ATPとADP | |
| パラジウム | 琥珀 |
原子の発見
化学の色々な反応は、もとをただせば原子と原子の相互作用。でも、実際に原子の存在が確認されるのは、アインシュタインが登場するよりも後の時期なのです。
高校の化学で、習うアボガドロ数。たしか、NA=6×1023 /molだった。アボガドロ(1776年~1856年)とは、イタリア・サルデーニャ王国トリノ出身の物理学者で、1811年に発見した『同圧力、同温度、同体積の全ての種類の気体には同じ数の分子が含まれる』というアボガドロの法則で有名な人。でも、アボガドロ数が数えられるようになったのは、ずっと後世の世界。
それまでは、化学の世界での原子は一つの作業仮説(原子を考えた方が説明が簡単)としてしか認識されてなかったのです。モルという単位も1番軽い水素原子1gを1モルと決めてだけ。でも、こう決めることで、化学反応は定量的に理解されるようになって来ます。でもこんな状態で、元素の周期律表を完成させたメンデレーフの業績はやはりすごいと言わざるを得ません。
【アボガドロの法則】
アボガドロの時代は仮説でした。同一圧力、同一温度、同一体積のすべての種類の気体には同じ数の分子が含まれるという法則です。この同じ数としてエイヤーと決めたのがモルという数字です。1モルの水素分子は2g、酸素分子は16gとなることは、化学反応式を見れば理解できると思います。
以下は、説明のため簡単な問題を解いてみます。
【問題】22.4リットルの瓶の中に、水素が入っています。中は1気圧に保たれています。1気圧のもとでは、どのような気体も22.4リットルで1モルとなることが実験的に確認されていました(アボガドロの時代)。この中に水素の分子は6×1023個(アボガドロ定数)ある訳ですね。勿論アボガドロ数が実測できるようになるのはズート後のこと。これから、水素原子の重さと大きさは出て来るでしょうか。
【解答】水素は、普通単体では存在出来ないので、H2の水素分子となっています。
この水素分子1個の占める体積Vと重さWは、
V=(22.4×103cm3)÷(6×1023)=3.73×10-20 cm3
水素分子1モルは2gですから
W=2÷(6×1023)=3.33×10-24
従って、水素原子1個の重さは、この半分の1.67×10-24gと分かります。これは、物理の本に出ている陽子及び中性子の質量と同じです(実際は中性子の方がわずかに重い)。
高校生では、かなりの生徒がアボガドロ数は、アボガドロが発見したと思っているのではないでしょうか。でも、実際の科学の歴史は全く異なっています。アボガドロ数を求めるには、量子論の裏付けが必要で、高校生レベルでは手も足も出ません。上の問題とは逆で、原子の大きさが分かって初めてアボガドロ数が求まるのでした。ということは、アボガドロの法則は、実験的事実で、このことは原子の存在とは無関係。原子はあくまでも作業仮説。高校レベルの化学では、作業仮説の段階ですべて説明されてきたことは、歴史によって証明されています。確かに、原子の存在を認めれば化学の現象の説明には楽そうに見えるかも知れません。ただここのところをはっきりさせておかないと化学への理解に対してかえって混乱を招くことになるでしょう。
 物資を細かく分けると、分子に行きつく。鉄もタンパク質もどんどん細かく分けて行っても鉄、たんぱく質に変わりはない。考えられる最小の単位が分子。原子はその分子を分けるとその根源的な構成要素として出て来るものだ。古代から万物はより簡単な要素の組合せから出来ているとの考えはあって、古代ギリシアのデモクリトスの原子論、中国でも木火土金水(もっかどごんすい)等の陰陽道みたいな考えもあった。陰陽道は、実生活にも応用されたでしょうが、原子の存在は、証明することはもちろん不可能でした。
物資を細かく分けると、分子に行きつく。鉄もタンパク質もどんどん細かく分けて行っても鉄、たんぱく質に変わりはない。考えられる最小の単位が分子。原子はその分子を分けるとその根源的な構成要素として出て来るものだ。古代から万物はより簡単な要素の組合せから出来ているとの考えはあって、古代ギリシアのデモクリトスの原子論、中国でも木火土金水(もっかどごんすい)等の陰陽道みたいな考えもあった。陰陽道は、実生活にも応用されたでしょうが、原子の存在は、証明することはもちろん不可能でした。
近代化学が発展して、化学反応に定量分析の方法が確立して来ます。この結果、反応の前後では系の質量は保存される(質量保存の法則)や反応する物質の質量同志は必ず同じ簡単な整数比になる。このような事実の積み重ねから、物質の基本として元素(化合物とは異なるとの意味で)というものがあることが分かってきます。元素と原子はちがうものですが、元素の構成要素の最小のものとして原子のようなものを作業仮説として設定すると大変便利であることが分かって来ました。また、元素の相対質量(もっとも軽い水素を1として、現在は炭素を12とする)を、その順に並べ表にすると、周期的に似た元素があらわれることをメンデレーフという人が発見します。でも、この当時は、実際に原子の存在を確認できると信じていた人は、物理学者も含めていなかったようです。ということは、原子が結合してできる分子の存在も同じく確認は出来ていなかったはずです。
scienceの部屋
無機化学の世界
酸化と還元
酸化と還元は高校の化学においての重要な概念。生物は食べ物を酸化してエネルギーを得る。ということは、光合成はCO2を還元して栄養をつくるのか。ということは、酸化とはエネルギーを放出する反応で、還元はエネルギーを蓄える反応ではないか。意外と奥の深い内容を秘めている可能性がある。化学反応においては酸化と還元は同時に進行していることもポイントです。
1.酸素のやり取り
酸素をもらう反応が酸化、酸素を放出する反応が還元。
2Cu+O2→2CuO
銅が酸化銅になった。
CuO+H2→Cu+H2O
酸化銅が還元されて、銅地金にもどる。
2Mg+CO2→2MgO+C
熱したマグネシウムを炭酸ガスの入った瓶にいれても燃える。マグネシウムは酸化され、代わりにCO2を還元する。
2.水素のやり取り
水素を放出する反応が酸化、水素をもらう反応が還元。
2H2S+O2→2S+2H2O
硫化水素は水素を奪われて酸化され、代わりに酸素が還元された。酸素も還元されるんですね。
2H2+O2→2H2O
この場合は、水素は酸化されて、酸素は還元されたというのでしょうね。
3.電子のやり取り
電子を失うのが酸化、電子を受け取るのが還元。
2Cu+O2→2CuO
Cuは電子を失いCu2+になり、酸素は電子を受取りO2-になります。でも、電子の存在は20世紀になるまで分からなかったのです。イオンや電荷は知られてましたが。
4.酸化数で決める
酸化は酸化数を目安に考えるのが手っ取り早い。酸化数は次のように求められます。酸化数が増えれば酸化された。酸化数が減れば還元されたことになるのです。
①単体の原子の酸化数は0
②イオンの酸化数は、その価数
③化合物中のH、Oの酸化数は原則1、-2とする
④化合物を構成する原子の酸化数の総和は0
実例
1. CH4:Cの酸化数をxとすると、x+(1×4)=0からx=-4 (炭素は還元されている)
2. CO2:Cの酸化数をxとすると、x+(-2×2)=0からx=4 (炭素は酸化されている)
3. SO2:Sの酸化数をxとすると、x+(-2×2)=0からx=4 (硫黄は酸化されている)
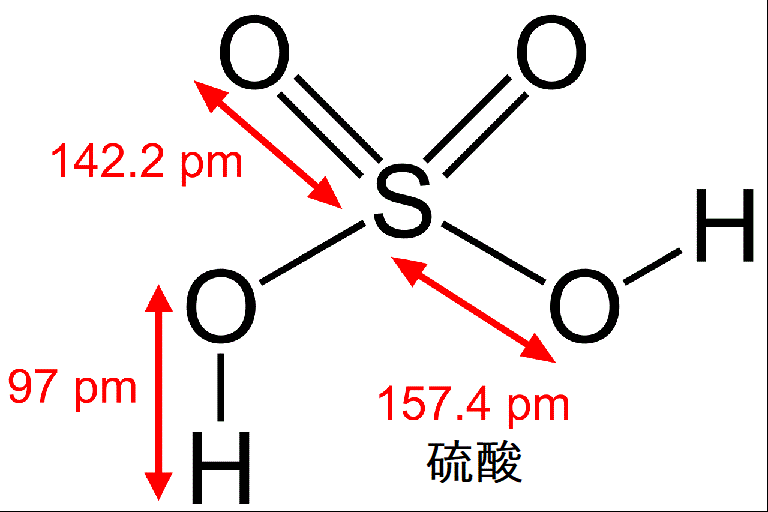
4. H2SO4:Sの酸化数をxとすると、(1×2)+x+(-2×4)=0からx=6 (硫黄は酸化されている)
SO42- :Sの酸化数をxとすると、x+(-2)×4=-2からx=6 (上と同じです)
5. NH3→Nの酸化数をxとすると、x+(1×3)=0→x=-3 (窒素は還元されている)
6. HNO3:Nの酸化数をxとすると、1+x+(-2×3)=0からx=5 (窒素は酸化されている)
NO3-:Nの酸化数をxとすると、x+(-2×3)=-1からx=5 (上と同じ)
7. C2H6:Cの酸化数をxとすると、2x+(1×6)=0からx=-3 (炭素は還元されている)
8. MnO4-:Mnの酸化数をxとすると、x+(-2)×4=-1からx=7
対象となる原子の酸化数が増加した時その原子は酸化されたといい、反対に酸化数が減少した時に還元されたという。
酸化と還元は地球環境にとって重要な要素です。地球上に生命が誕生するためには、大気中の気体が十分還元されていて、生命の構成要素となる前駆物質が作られていなければならないからです。酸化と還元という化学的なプロセスには電子がかかわっているのです。電子を失う反応が「酸化」、電子を得る反応が「還元」です。電子はエネルギーの通貨のようなもので、エネルギーと交換できるものです。還元で電子を得ることは銀行にお金を預けるようなものです。例えば、石油も石炭も「還元」された状態。だから燃やすと大量のエネルギーが得られるのです。人類は化石燃料を大量消費することで過去に地球に貯金(還元)されていた貯金を大量に使い果たしています。温暖化など色々な影響が心配ですね。
例えば、2C2H6+5O2→4CO2+6H2O
これは炭化水素エタンの燃焼で、C2H6→2CO2
炭素の酸化数をxとすると、左辺は2x+6=0→x=-3
右辺は、x-2×2=0からx=4、炭素の酸化数は-3から4に増加。酸化されています。光合成は還元反応。呼吸は酸化反応です。
scienceの部屋
酸と塩基
酸と塩基の考えは化学の研究の上で重要な考えのようです。何故なのでしょうか。学んでいくうえで分かるでしょうか。
酸と塩基の定義としてはスウェーデンのアレニウス(1859~1927)のものがあります。定義では、水素イオンH+と水酸化物イオンOH-を用います。

 ●酸とは、水に溶けてH+を出すもの
●酸とは、水に溶けてH+を出すもの
●塩基とは、水に溶けてOH-を出すもの
つまり、
酸;HA→H++A-
塩酸;HCl→H++Cl- (一価の酸)
硝酸;HNO3→H++NO3- (一価の酸)
硫酸;H2SO4→2H++SO42- (二価の酸)
酢酸;CH3COOH→H++CH3COO- (一価の酸)
リン酸;H3PO4→3H++PO43- (三価の酸)
塩基;BOH→B++OH-
水酸化ナトリウム;NaOH→Na++OH- (一価の塩基)
水酸化カルシウム;Ca(OH)2→Ca2++2OH- (二価の塩基)
とりあえず、どんな物質が酸で、どんな物質が塩基かは何となく分かって来る。でも、何故この考えが大事なのか今一つありがたみが分からない。
酸化と還元で次のようなことを学んだ。電子を失うのが酸化、電子を受け取るのが還元。
酸では、H+イオンを放出する。だから化学反応でこの水素を受け取れはその物質は還元されたことになる。
塩基では、OH-イオンを放出する。だから化学反応でこの水酸基を受け取れば電子を取られて酸化されることになる。
【追記】ガラスはアルカリに溶ける
学校で化学の実験をしているときには気がつかなかったが、濃厚なアルカリ溶液はガラスの容器には入れないようだ。ガラスもガラスに種類によるがアルカリや熱水に侵されることもあるらしい。そのため原則としてペットボトルのようなプラスチックの容器に入れるのだそうだ。
濃厚なアルカリ溶液(実際には水酸化ナトリウムや水酸化カリウムなどの強塩基性水酸化物だけだろうが)空気中の炭酸ガスを吸収する。また、濃厚な強塩基性溶液は粘度も高く、ガラスの「へり」に残留しやすく、固着の原因になる。ガラスの主成分である珪酸ナトリウムが侵されるためだそうだ。
また、ガラスを粉砕し、煮沸するとpHが高くなるそうだ。同じ水でもペットボトルに入っている水とガラス容器に入っている水では、珪酸の濃度が後者の方が高いことが確かめられている。ガラス製のポットを長く使うとシリカなどが溶出するため、穴があくこともあるという。ボーキサイトは、珪酸アルミニウム等の鉱物が熱帯地方の暖かくて大量の雨のため、珪酸を徐々に溶出してできると言われている。(2019.4.7)
【酸と塩基を再定義】
アレニウスの定義では、酸と塩基は水に溶ける物しか定義できない。この欠点を補うため、ブレンステッドとローリーは、アレニウスの定義において中心的な役割を果たしているH+、すなわちプロトン(陽子)をベースとして、酸と塩基の概念を以下のように再定義した。
●酸とはプロトンH+ を他の物質に渡すことができる物質
●塩基とはプロトンH+を他の物質から受け取ることができる物質
よってブレンステッド・ローリーの定義における酸と塩基をそれぞれプロトン供与体、プロトン受容体ともいう。なおブレンステッド・ローリーの定義では通常の分子である場合はもちろん、イオン化した分子に対しても酸や塩基が定義できる利点がある。
アレニウスの定義との関係
アレニウスによる酸の定義は、ブレンステッド・ローリーによる酸の定義における「他の物質」が水分子であり、しかもH+を水分子に渡す原因が解離である場合に相当するので、ブレンステッド・ローリーによる酸の定義はアレニウスによる酸の定義を含意する。
一方ブレンステッド・ローリーによる塩基の定義はアレニウスによる塩基の定義と見かけ上大幅に異なるが、アレニウスによる塩基の中に存在するOH-が「他の物質」である反応相手の酸からH+を奪って水分子H2O を生成すると考えれば、ブレンステッド・ローリーによる塩基の定義がアレニウスによる塩基の定義を含意する事が分かる。
アレニウスの定義と違い、定義の範囲を水溶液に限定していないので、アレニウスの定義にあった「水溶液にしか定義できない」という欠点は解消されている。
また、ブレンステッド・ローリーの定義は、アレニウスの定義と違い、アンモニアが水に対して塩基になる事を説明できる。実際、アンモニアが水分子と反応して加水分解する過程
NH3 + H2O ←→ NH 4+ + OH−
において、アンモニアは水分子からH+ を奪っているので、ブレンステッド・ローリーの定義における塩基である。
酸と塩基の定義は、更に拡大されており、ルイスの定義、ウサノビッチの定義などが提案されている。
scienceの部屋
元素の周期律表

scienceの部屋
炎色反応
炎色反応
 炎色反応(えんしょくはんのう)とは、アルカリ金属やアルカリ土類金属、銅などの金属や塩を炎の中に入れると各金属元素特有の色を示す反応のこと。金属の定性分析や、花火の着色に利用されている。
炎色反応(えんしょくはんのう)とは、アルカリ金属やアルカリ土類金属、銅などの金属や塩を炎の中に入れると各金属元素特有の色を示す反応のこと。金属の定性分析や、花火の着色に利用されている。
熱エネルギーによって外殻へ励起(れいき)した電子が基底状態へ戻る際に生じる発光が炎色反応である。高温の炎中にある種の金属粉末や金属化合物を置くと、試料が熱エネルギーによって解離し原子化される。それぞれの原子は熱エネルギーによって電子が励起し、外側の電子軌道に移動する。励起した電子はエネルギーを光として放出することで基底状態に戻り、この際に元素に特徴的な輝線スペクトルを示す。したがって、比較的低温で熱励起され、発光波長が可視領域にある元素が、微粉末や塩化物のような原子化されやすい状態になっているときにのみ、炎色反応が観察される。
炎色反応の映像
scienceの部屋
有機化学の世界
目次
| 分子の構造式---レゴブロックと同じだ | 異性体 | 有機分子模型 | ||
| タンパク質とアミノ酸 | ||||
| アミノ酸の構造 | 油脂 | 糖類 | ||
| 細胞とは何か | Health Effects of Fish Oil | Trans fat | ビタミン | 酵素 |
分子の構造式---レゴブロックと同じだ
有機化学はある意味で無機化学よりも学びやすい。主役は常に炭素であり、水素は補助役、その他の元素は本当に脇役になる。化学的性質は脇役が大活躍するのですが。炭素は、最外殻電子を4つもつため、4本の共有結合の手をもっているため、ちょうどレゴブロックを組み合わせていくように、巨大な分子も作り出すことが可能になる。実際、化学を学ぶため分子模型をつくれるブロックが販売されています。
まず、初めに炭素1個。4個の手に水素が一つずついて出来るのがCH4(メタン)。ちょうどテトラポッドの形。有機化合物の分子では、分子に加えて構造式も大事。下図に例を示します。

ここで、簡略図の書き方を覚えると便利。あなたは化学のレゴブロックの達人に変身できます。コツは、炭素は各線分の端点に位置します。水素は手が1本。CもHも表記しません。残りの元素の手の数を考えながら付け加えて出来上がり。市販の分子模型ブロックの穴の数は手に数に対応しています。穴の配置は立体的で組み立てるのはパズル性があり結構面白いです。図では平面で書かれているので組み立てて見ると最初思っていたのと形が少しことなります。手に数は、炭素が4、水素が1、酸素が2、窒素が3、燐が5となっています。
有機化学の世界
scienceの部屋
異性体
男性・女性の異性ではなく、同じ化学式でも炭素の手の握り方で異なった形や性質の分子があることです。下図を見て下さい。

炭素と水素だけの飽和炭化水素(2重結合、3重結合がない)CnH2n+2でも、炭素の数が増えると異性体は急激に増えていきます。不飽和の場合は、2重結合、3重結合のある場所も関係します。
回転異性は、簡単に回せそうですが、シス・トランスの関係は2重結合があるので回転は不可能でしょう。また、光学異性も鏡に映した関係で決して重ねることが出来ません。これらは、D型、L型として区別していますが、dextro-rotatory(右旋性)、levo-rotatory(左旋性)に由来するらしいです。これは、光(偏光)をあてた際に旋回が逆になることからきているのです。 生物現象を扱う生化学の分野では、これは極めて重要な点で、何故かタンパク質の原料としては、L型のアミノ酸しか使われることがありません(多少の例外はあるらしい)。また、エネルギー源としてはD型の糖しか使われません。生命の歴史の初期にアミノ酸はL型、糖はD型と決まったからと考えられています。人工的に合成するとL型、D型は同じくらい出来てしまうのに、生体での化学反応はキチンと区別がなされています。生体では化学反応を促進するには酵素というたんぱく質が使われますが、酵素は普通の触媒とは異なり特定の条件下で特定の物質としか反応しないという特徴があります。ここに秘密があるのではないかと考えられ要るようです。
トランス脂肪酸の健康への影響が問題になったことがあります。生体はL-タンパク質やD-糖しか使えないのと同じように、シス型の脂肪酸しか使えないようです。もちろん、自然界にも食品由来のトランス型の脂肪酸は存在しているので、全く摂取しないわけには行きません。また、大量の摂取は癌などもリスクが増えることも指摘されています。厚生労働省の見解では、日本人は欧米人に比べて脂肪の摂取量が少ないから問題は無いと発表しました。確かに、肉や魚、あるいはナッツ類に含まれる脂肪は問題にならないのは明らかです。
問題なのは、工業的に生産される食用油でしょう。むしろ植物性の油の方が問題かも知れません。安価に大量に生産するためには、加熱とか水素を付加するという工業的なプロセスがどうしても入り込みます。そうすると必ず、半分程度はトランス脂肪酸が含まれてしまいます。現状の技術では分離出来ないのです。昔ながらの農家の庭先で行うような方法では、大手の食品産業は儲かりません。厚生労働省が何故あのような見解を発表したか意図は明らかでしょう。
有機化学の世界
scienceの部屋
有機分子模型
分子模型のブロックを入手しました。各原子に共有結合の価数(手の数)に相当する穴が空いていて、手に当たる棒をつないで組み立てていきます。
まず最初の写真は、空気の成分、水素H2、酸素O2、窒素N2、水蒸気(水)H2O、炭酸ガスCO2です。水素は白、酸素は赤、窒素はライトブルー、炭素は黒の球で表されています。水素、酸素、窒素はそれぞれ単結合、二重結合、三重結合になっている点にご注意下さい。


炭化水素の例です。炭素が一つ増えるごとに、メタン、エタン、プロパンと呼び名が変わっていきます。炭素は腕が4本、水素は1本で、飽和炭化水素の一般式は、CnH2n+2で表されます。

炭化水素のHをOHで置き換えたものをアルコールと称します。OHの数で一価、二価、三価などがあります。晩酌で毎晩飲むのはエチルアルコール。高級アルコールは絶対飲んではいけません。

アルコールは、

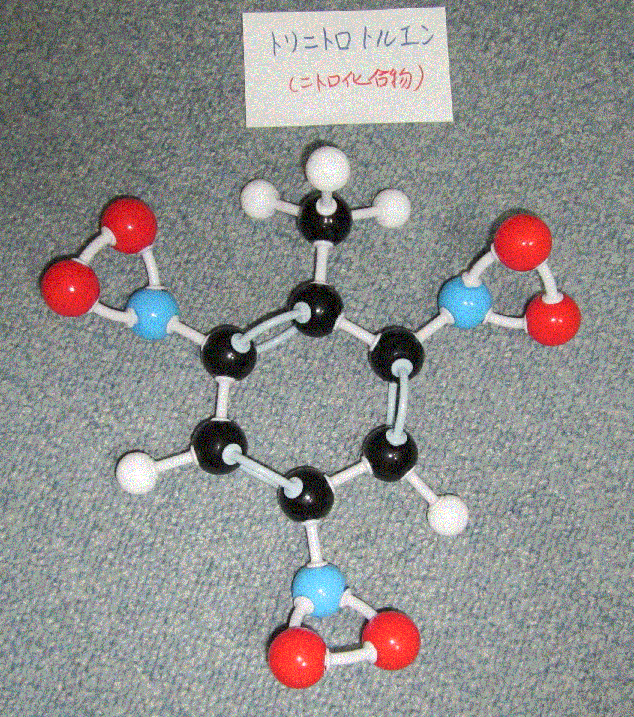
ベンゼンは、芳香族炭化水素。原油の中にも含まれる。ベンゼン環という炭素が6角形環状に並んだ構造になっており、二重結合が3つというユニークな形をしている。この2重結合と単結合が互いに交換し合って安定な状態になっている。水素を他の官能基で置換することで、色々な分子を構成します。付加反応よりも置換反応の方が起こりやすいという特徴があります。つまり、ベンゼン環と言う2重結合のある六角形が安定な構造ということなんでしょう。ベンゼン由来の化合物→クロロベンゼン、アニリン、フェノール(石炭酸)、トルエン等。

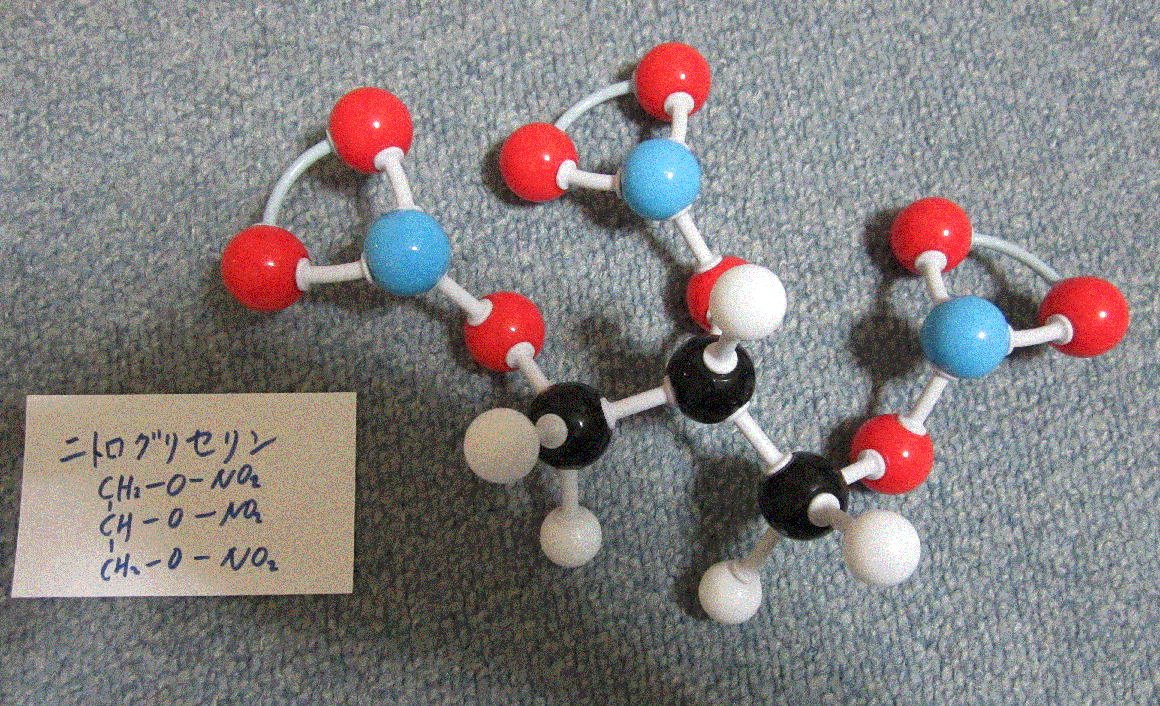
トリニトロトルエンは、TNT火薬。ニトログリセリンも爆発する液体です。
有機化学の世界
scienceの部屋
タンパク質とアミノ酸
タンパク質は生物の細胞を構成する大事な物質。タンパク質を加水分解するとアミノ酸になります。逆にタンパク質は沢山のアミノ酸が脱水縮合(ペプチド結合という)してできたもの。アミノ酸は不斉(ふせい)炭素と言われる1つの炭素にアミノ基(-NH2)、カルボキシル基(-COOH)、水素(-H)、適当な置換基(-Rとする)の4つがついた構造をしており、2種類の光学異性(鏡像異性)があり、それぞれL型、D型と呼ばれていますが、生物が利用できるのは何故かL型だけです。食事で摂取したタンパク質は、消化で分解されてバラバラのアミノ酸となり小腸から吸収されて、DNAやRNAの指令に従って再度合成されてタンパク質になって体の一部に生まれ変わります。

有機化学の世界
scienceの部屋
アミノ酸の構造
アミノ酸がペプチド結合して、さらに立体的に構造をしているのがタンパク質。総ての生物のタンパク質は20個のアミノ酸の組合せで出来ています。中心にはアミン基、カルボキシル基、水素、側鎖基の4つの全く異なった基が結合しており、この炭素は不斉炭素と呼ばれます。そのためL型、D型の鏡像異性体があるが、生物に利用され自然界に存在するアミノ酸はすべてL型となっています。生物が単一の祖先から進化してきたことを示唆しているのでしょう。アミノ酸の基本構造は、みな同じであり化学的な性質の違いは側鎖の違いに依存している。
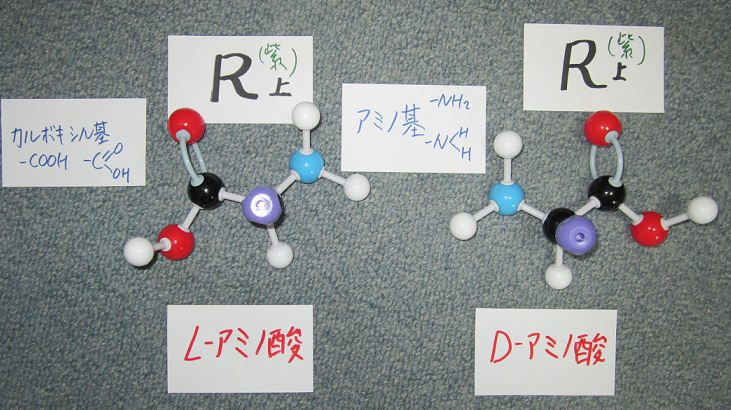
側鎖を薄紫の玉で表しています。
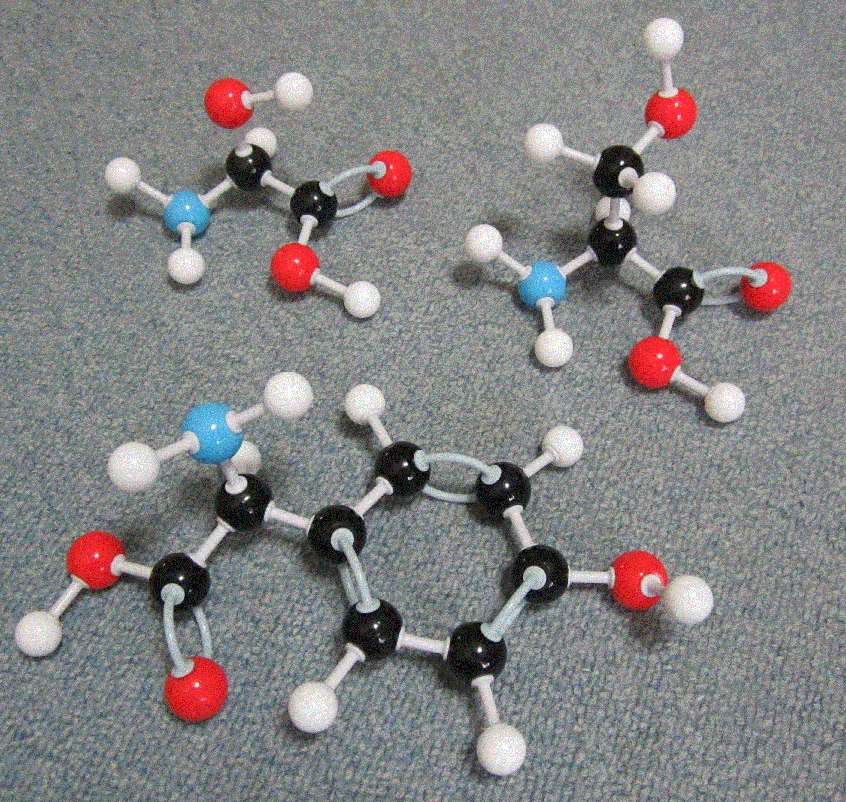

カルボキシル基-OHとアミン基のHが取れて、脱水縮合がおこり、ペプチド結合が作られます。これが長くなり、さらに折りたたまれて複雑な立体構造となります。

以下、生物の細胞を構成する20個のアミノ酸の一覧を示します。
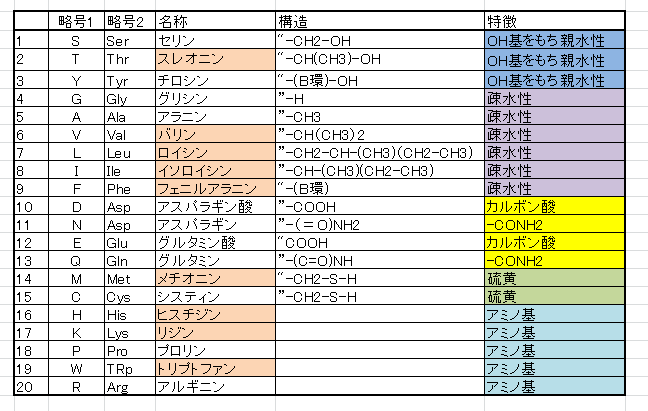
**必須アミノ酸
必須アミノ酸(Essential amino acid、EAA)とは、タンパク質を構成するアミノ酸のうち、その動物の体内で充分な量を合成できず栄養分として摂取しなければならないアミノ酸のこと。必要アミノ酸、不可欠アミノ酸とも言う。ヒトでは、一般に次の8種ないしヒスチジンを追加した9種類が必須アミノ酸に含まれる。上の表中で薄茶色に色付けしたものに相当する。
トリプトファン、リジン、メチオニン、フェニルアラニン、スレオニン、バリン、ロイシン、イソロイシン、ヒスチジンの9種類。
有機化学の世界
scienceの部屋
油脂
生物の体にはいたるところに油脂が含まれています。油脂は、グリセリンという3価のアルコールと脂肪酸というカルボン酸 3 個が脱水縮合したものです。グリセリンはどの油脂にも共通ですので油脂の個性は脂肪酸の性質で決まります。脂肪酸は長い炭素鎖を持っていますが、その中に二重、三重結合を含むものを不飽和脂肪酸、含まないものを飽和脂肪酸と称しています。動物性の油脂は主に飽和脂肪酸ですが、植物や魚の油脂には不飽和脂肪酸が含まれています。青魚に含まれ健康に良いと言われるEPAやDHAは不飽和高級脂肪酸(高級とは炭素の数が12以上の長い炭素鎖からなる)です。

有機化学の世界
scienceの部屋
Health Effects of Fish Oil
Fish oil is rich in n-3 polyunsaturated fatty acids such as docosahexaenoic acid (DHA) and cicosapentaenoic acid (EPA). These fatty acids are generally recognized as biologically important lipids that play a significant role in protecting against cardiovascular disease, cancer, and inflammation. Moreover, many studies demonstrate that intake of fish oil, especially DHA, influences brain development, learning and memory, and visual function. Recently, the preventative and remedial effects of DHA oil on dementia and mental disorders have been reported. In this review, the health benefits of fish oil are summarized, and new data on the effects of DHA oil on intelligence score and visual acuity in the elderly are presented.
魚、特に青魚に含まれる不飽和脂肪酸が健康に良いとかなり前から言われています。DHA(ドコサヘキサエン酸)とかEPA(エイコサペンタエン酸)とか。テレビでも良く聞きます。n-3多価不飽和脂肪酸とは一体何でしょうか。fatty acids が脂肪酸。オメガ3脂肪酸が健康にいいと言われてますね。


油脂は、グリセリンという3価のアルコールと脂肪酸というカルボン酸 3 個が脱水縮合したものです。つまり、グリセリンという物質に3種類の脂肪酸が結合したもの。
エイコサペンタエン酸(EPA:Eicosapentaenoic Acid)は、魚類、海藻類、プランクトンなどに多く含まれる多価不飽和脂肪酸です。 その構造は、20の炭素に5つの二重結合を有し、末端のメチル基より3番目の炭素に二重結合があることから、n-3系多価不飽和脂肪酸とよばれています。
また、ω系とn 系は同じ意味らしい(n-3 = ω-3)。
上の図は脂肪酸の模式図です。一番左が飽和脂肪酸。次がn-6の不飽和脂肪酸。一番右がn-9の不飽和脂肪酸。二重結合の位置が末端のメチル基(-CH3)から何番目かで名前が決まるですね。すると n-3 はここには無いけど3番目に不飽和結合があるということですね。
この脂肪酸が心血管疾患、癌、および炎症に対する抵抗力を高めるということなんです。更には脳の活性化に寄与するというのですが。lipidは脂質のこと。でも、同じ不飽和脂肪酸でも n-6 や n-9 はダメで、逆効果らしいのです。
何故、同じ食べるのでも魚ならよくて、肉はダメなのでしょう。海の魚はn-3が n-6やn-9 に対してバランスよく含まれているのに、肉は n-3 がほとんど含まれないためだそうです。こういう研究は我々より肉食中心の西欧諸国でも進んでいるようで、フランス政府は n-3 の含有量の多い牧草牛の輸入を推進しているとか。海に住む魚と違って、牛も豚も鶏も穀物中心で育てられるからか。野生の牛なら穀物何て絶対に口にしないからね。でも、穀物を食わせれば効率良く太らせることが出来る。肉のもとになる家畜自身が病んでいるということかも知れない。
有機化学の世界
scienceの部屋
Trans fat
{From Wikipedia, the free encyclopedia}
Trans fat, also called trans-unsaturated fatty acids or trans fatty acids, is a type of unsaturated fat that occurs in small amounts in meat and milk fat. It became widely produced as an unintentional byproduct in the industrial processing of vegetable and fish oils in the early 20th century for use in margarine and later also in snack food, packaged baked goods, and for frying fast food.
トランス脂肪酸は不飽和脂肪酸にのみ生ずる。不飽和脂肪酸はシス型とトランス型が異性体として存在する。総ての生体はシス型しか利用できなのですが、肉やミルクには少量含まれるようだ。20世紀になってマーガリンやスナック菓子、その他加工食品のため植物油や魚油を工業的に加工するようになって、副産物として意図せざる混入が生じるようになったようだ。
Fats contain long hydrocarbon chains, which can be either unsaturated, i.e., have double bonds, or saturated, i.e., have no double bonds. In nature, unsaturated fatty acids generally have cis as opposed to trans configurations. In food production, liquid cis-unsaturated fats such as vegetable oils are hydrogenated to produce saturated fats, which have more desirable physical properties: e.g., they melt at a desirable temperature (30–40 °C); and extend the shelf-life of food. Partial hydrogenation of the unsaturated fat converts some of the cis double bonds into trans double bonds by an isomerization reaction with the catalyst used for the hydrogenation, which yields a trans fat.
脂肪は、長い炭化水素の鎖を有しており、飽和している場合もあるが、不飽和で二重結合を持っているものが多い。不飽和二重結合では必然的にトランスとシスの形態が出来る。食品加工では物理的特性を変化させ、賞味期限を長引かせるため、部分的に水素添加を行う。部分的に水素添加を行う際にシス型の一部がトランス型に変化してしまうようだ。完全に飽和した脂肪酸なら全く問題がない。ただし、不飽和脂肪酸の方が健康に良いものも含まれているので話は簡単ではなさそうだ。
**shelf-life=賞味期限
Although trans fats are edible, consuming trans fats has been shown to increase the risk of coronary artery disease in part by raising levels of low-density lipoprotein (LDL, often termed "bad cholesterol"), lowering levels of high-density lipoprotein (HDL, often termed "good cholesterol"), increasing triglycerides in the bloodstream and promoting systemic inflammation.
トランス脂肪は食べることは可能ですが、低密度リポタンパク質(LDL、悪玉コレステロール)のレベルを上げ、高密度リポタンパク質(HDL 、善玉コレステロール)のレベルを下げ、血流中のトリグリセリドを増加させ、全身性炎症を促進するとされている。やはりあまり安全なものではないようだ。
Trans fats also occur naturally, e.g., the vaccenic acid in breast milk, and some isomers of conjugated linoleic acid (CLA). These trans fats occur naturally in meat and dairy products from ruminants. Butter, for example, contains about 3% trans fat. Two Canadian studies have shown that vaccenic acid could be beneficial compared to hydrogenated vegetable shortening, or a mixture of pork lard and soy fat, by lowering total LDL and triglyceride levels. A study by the US Department of Agriculture showed that vaccenic acid raises both HDL and LDL cholesterol, whereas industrial trans fats only raise LDL with no beneficial effect on HDL.
トランス脂肪はもちろん自然界でも発生する(例:母乳中のバクセン酸、および共役リノール酸(CLA)の一部の異性体)。例えば、反芻動物の肉や乳製品にも自然に含有されています。だから、それを加工したバターやチーズにもには約3%程度ののトランス脂肪が含まれることになります。
カナダの2つの研究では、総LDLとトリグリセリドのレベルを下げることにより、水素添加野菜ショートニング、または豚肉と大豆脂肪の混合物と比較して、バクセン酸が有益であることが示されています。米国農務省の研究では、バクセン酸はHDLとLDLの両方のコレステロールを上昇させるが、工業用トランス脂肪はLDLを上昇させるだけで、HDLに有益な効果はないことが示されました。→要は害はあっても益無し。できれば取らないにこしたことは無いようだ。
**バクセン酸:英語: Vaccenic acidは、反芻動物の脂肪および牛乳やヨーグルトなどの乳製品中に見られるトランス脂肪酸。 IUPAC名は(E)-11-オクタデセン酸で、数値表現では18:1 trans -11と表される。 化合物名の由来はラテン語のvacca(ウシ)である。
アルバータ大学での2008年の研究で、ラットに16週間以上バクセン酸を与えた結果、全コレステロール濃度、LDLコレステロール濃度およびトリアシルグリセロール濃度が低下したと報告された。研究者らはヒトでの臨床実験を含むさらなる研究を行っている。トランス脂肪酸でも善玉もあるかもしれないという研究でしょうか。
In light of recognized evidence and scientific agreement, nutritional authorities consider all trans fats equally harmful for health and recommend that their consumption be reduced to trace amounts. The World Health Organization recommended that trans fats make up no more than 0.9% of a person's diet in 2003[19] and, in 2018, introduced a 6-step guide to eliminate industrially-produced trans-fatty acids from the global food supply.
認められた証拠と科学的合意に照らして、栄養当局はすべてのトランス脂肪が健康に等しく有害であると見なし、それらの消費を微量に減らすことを推奨しています。
世界保健機関は、2003年にトランス脂肪が人の食事の0.9%以下を占めることを推奨し、2018年に、世界の食料供給から工業生産されたトランス脂肪酸を排除する6段階のガイドを導入しました。
In many countries, there are legal limits to trans fat content. Trans fats levels can be reduced or eliminated by switching to saturated fats such as lard, palm oil, or fully hydrogenated fats, or by using interesterified fat. Other alternative formulations can also allow unsaturated fats to be used to replace saturated or partially hydrogenated fats. Hydrogenated oil is not a synonym for trans fat: complete hydrogenation removes all unsaturated fats.
多くの国では、トランス脂肪含有量に法的制限があります。 トランス脂肪レベルは、ラード、パーム油、または完全に水素化された脂肪などの飽和脂肪に切り替えるか、エステル交換脂肪を使用することで、削減または排除できるとしています。 他の代替製剤により、不飽和脂肪を使用して飽和または部分水素化脂肪を置換することもできます。 硬化油はトランス脂肪の同義語ではありません。完全な水素添加はすべての不飽和脂肪を除去します。
トランス脂肪酸の問題は20世紀の食品加工業の発展に伴って、生じたもののようだ。自然界に存在する1% 以下の量なら全く問題が無いようだ。何故が日本の厚労省は日本人は油の摂取量が欧米人より少ないから特別な対策が不要としているが、食品加工業界の意向を忖度しているようだ。多くの国に見習いきちんと対策を取ればほぼ完全に排除できる問題のようですが。少なくとも企業にはトランス脂肪含有量の表示を義務付けることは必要だろう。
有機化学の世界
scienceの部屋
糖類
分子式が Cm(H2O)n と表せる分子を炭水化物と言います。一番簡単な形のグルコース(ぶどう糖)とフルクトース(果糖)は、単糖類と呼ばれます。単糖類は脱水縮合によってより大きな分子を作ります。数百から数万個つながったものがデンプンやセルロースです。


有機化学の世界
scienceの部屋
触媒
触媒(しょくばい、catalyst)とは、一般に、特定の化学反応の反応速度を速める物質で、自身は反応の前後で変化しないものをいう。でも、自分自身は何の変化もしないで他の物質同士の反応を促進するなんて魔法のような力はどこから生み出されるんだろう。
化学的には触媒は化学反応を促進させるような物質のことであり、光、放射線、超音波など化学反応を促進させることがあっても化学物質とはいえないものは通常は触媒とは言わない。化学分野では化学反応において反応物よりも少量でそれ自体は化学反応中に変化しないものを触媒ということが多い。他方、触媒は化学だけでなくそれに隣接する物理学や生物学でも用いられる概念であり、生体触媒のRNAのように反応分子と触媒分子が一体となっているものもあることから、より広く定義される場合もある。ただ、生化学の分野では触媒と言うより「酵素(enzyme)」と言う語の方が多用されている。この区別は?
「触媒」という用語は明治の化学者が英語の catalyser、ドイツ語の Katalysator を翻訳したもの。今日では、触媒は英語では catalyst、触媒の作用を catalysisという。
今日では反応の種類に応じて多くの種類の触媒が開発されている。特に化学工業や有機化学では欠くことができない。
1823年にドイツの化学者であるヨハン・デーベライナーは、白金のかけらに水素を吹き付けると点火することに気がついた。白金は消耗せず、その存在によって水素と空気中の酸素とを反応させることを明確にした。スウェーデンの化学者であるイェンス・ベルセリウスは、この白金の作用と同じ原因が他の化学反応や生物体の中にも広く存在するとし、触媒力と名付けた。
 触媒は反応の速度を増加させる。適切な触媒を用いれば、通常では反応に参加しないような活性の低い分子(例えば水素分子)を反応させることができる。しかし原系(反応基質側)や生成系(生成物側)の化学ポテンシャルを変化させないため、反応の進行する方向(化学平衡)を変えることはない。すなわち自発的に進行する方向に反応の速度を増加させる働きを持つ。言い換えれば、自発的に起こり得ない方向への反応は触媒を用いても進行しない。
触媒は反応の速度を増加させる。適切な触媒を用いれば、通常では反応に参加しないような活性の低い分子(例えば水素分子)を反応させることができる。しかし原系(反応基質側)や生成系(生成物側)の化学ポテンシャルを変化させないため、反応の進行する方向(化学平衡)を変えることはない。すなわち自発的に進行する方向に反応の速度を増加させる働きを持つ。言い換えれば、自発的に起こり得ない方向への反応は触媒を用いても進行しない。
**下り坂に止まっている車をチョット押してやるようなものか??
例えば、室温において水素と酸素から水が生成する反応は、反応前後でのギブズ自由エネルギー変化 ΔG < 0 であるため自発的に進行し、白金触媒を用いると反応速度を増加させることができる。一方、水が水素と酸素に分解する反応は室温では ΔG > 0 であるため、どのような触媒を用いても自発的には進行しない。 ΔG > 0 となる反応を進行させるには生成物を連続的に系外に排出するか、外部から電気や光などのエネルギーを与える必要があり、場合によっては電極触媒や光触媒を利用して反応速度を向上させる(記事 化学ポテンシャルに詳しい?)。
機構
触媒は反応物と反応中間体を形成することで、反応に必要とされる活性化エネルギーの低い別の反応経路を生み出す。例えば水素分子 H2 は強い H−H 結合を持つため反応性に乏しいが、水素化や燃料電池の触媒となる白金の表面では水素分子よりも遥かに反応性の高い H·種を形成する。これにより、触媒が存在しない場合よりも著しく高速に反応が進行する。
また、反応を早くするだけではなく、複数の反応が起こりうる状態において、目的とする物質を選択的に得るために触媒を用いる場合も多い。触媒は特定の反応のみ高速化させるためである。例えば一酸化炭素 (CO) を水素化する場合、用いる触媒により主生成物をメタン(ルテニウム触媒)、エタンなどの直鎖アルカン(コバルト触媒(FT合成))、メタノール(銅触媒)など変化させることができる。また、光学活性体の合成を行う場合には、不斉源となる BINAP やサレン錯体などの触媒を用いることにより立体選択性を発現させる。2001年のノーベル化学賞が金属錯体触媒を用いた不斉合成に授与されたように、その重要性はきわめて高く評価されている。
触媒は、物質表面の特定の部位、あるいは分子上の特定の位置(活性サイト)に、反応させたい物質が吸着・配位することで効果を発揮する。このため、目的とする物質よりも吸着・配位力が強い物質が共存すると、触媒の活性サイトが消失し、効果が著しく弱められる。このような物質を触媒毒という。
触媒とは反対に、存在によってある化学反応を遅らせる物質を、かつては負触媒(逆触媒)と呼んだ。しかし、負触媒自体が化学反応によって構造変化することなど、一般的な触媒の性質とは異なることから、現在では負触媒という用語は推奨されず、単に阻害剤(inhibitor)と呼ばれる。
なお、触媒反応の多くは、液体あるいは気体が、固体と不均一系を成して行われる界面反応であることが知られている。
有機化学の世界
scienceの部屋
ビタミンt
ビタミン(vitamin)は、生物の生存・生育に微量に必要な栄養素のうち、その生物の体内で十分な量を合成できない炭水化物・タンパク質・脂質以外の有機化合物の総称(なお栄養素のうち無機物はミネラルである)。
生物種によってビタミンとして働く物質は異なる。たとえばアスコルビン酸はヒトにはビタミン(ビタミンC)だが、多くの生物にはビタミンではない。ヒトのビタミンは13種が認められている。
**ビタミンCが体内で合成されないのは霊長類の特徴らしい。果実食のため食料から簡単に得られたため合成の遺伝子が消失してしまったらしい。
ビタミンは機能で分類され、物質名ではない。たとえばビタミンAはレチナール、レチノールなど。つまり化学的特性は色々。
ビタミンはほとんどの場合、生体内で十分量合成することができないので、主に食料から摂取される(一部は腸内細菌から供給される)。ビタミンが不足すると、疾病や成長障害が起こりうる(ビタミン欠乏症)。日本では厚生労働省が日本人の食事摂取基準によって各ビタミンの指標を定めており、摂取不足の回避を目的とする3種類の指標と、過剰摂取による健康障害の回避を目的とする指標、及び生活習慣病の予防を目的とする指標から構成されている。
アスコルビン酸(いわゆるビタミンC)は、コラーゲンの生成などの水素運搬体を必要とする多くの代謝経路に必須で、動物の生存に欠かせない生理活性物質である。ほとんどの哺乳類にとって体内で合成されて必要をまかなう物質であり、ビタミンではない。しかしヒトを含む多くの霊長類やモルモットのような一部の哺乳類では、これを合成する代謝経路を持っておらず、体外から食物としての摂取が生存上必須となっており、ビタミンに定義される。
またカロテノイド(いわゆるビタミンA)は、全ての生物の細胞内の代謝経路において重要な役割を果たす。たいていの生物、すなわち古細菌とほとんどの細菌、多くの真核生物(原生生物、植物、菌類)は、自らの代謝経路において合成することによってカロテノイドを自給しており、それらにとってはビタミンではない。しかし全ての後生動物はこの代謝経路を喪失しており、他の生物を捕食することによって摂取しなければならず、カロテノイドはビタミンである。
ビタミンは生体内において酵素がその活性を発揮するために必要な補酵素として機能するものとそうでないものに大別される。補酵素として生体内で働くものは主にビタミンB群として知られるものである。補酵素として機能しないものはビタミンA、ビタミンC、ビタミンD、ビタミンEおよびビタミンKである。補酵素であるかないかに関わらずビタミンは生体にとって必要不可欠な物質であり、ビタミン欠乏症に陥るとビタミンB群を補酵素として利用する酵素が関与する代謝系の機能不全症状が現れたり、ビタミンAが光を感知する物質の前駆体であるため夜盲症になったりする。ヒトのビタミンの一覧を挙げる。ビタミンは脂溶性ビタミンと水溶性ビタミンに分類される。
発見の歴史
ビタミンは通常の食事を取っていれば必要量が摂取できる。単調な食事や特殊な環境下での生活により、ビタミン不足による障害が発生するが、長い間それは単なる病気と見られていた。
ビタミン発見の発端は、兵士が壊血病や脚気に集団で罹り、当時の軍医らがこれらの病気の撲滅を狙って研究したことから始まる。現在ではこれらの病気はビタミン不足による障害だと知られている。
1734年、J・G・H・クラマーは壊血病に罹るのはほとんど下級の兵卒であり、士官らは罹らないことに気づいた。士官らは頻繁に果物や野菜を食べており、下級の兵卒らは単調な食事であることから、壊血病を防ぐために果物や野菜を取ることを勧めた。また、ジェームズ・リンドは 1747年、イギリス海軍で壊血病患者をいくつかのグループに分け異なる食事を与える実験を行った。その結果、オレンジやレモンの柑橘系果物が壊血病に有効であることを発見した。しかしこれらの発見は黙殺され、結局壊血病は 1797年にイギリス海軍において反乱が起き(スピットヘッドとノアの反乱)、その要求の一つにレモンジュースが入り、それが受け入れられるまでイギリス海軍を悩ませた(ただし、イギリス海軍本部は安価なライムを代用した)。
日本でも日本海軍の水兵に脚気が蔓延し悩まされた。軍医大監だった高木兼寛は、士官は脚気に冒されず、かつ単調な食事をしていないことに気づいた(脚気の原因のタンパク質の不足説と米よりタンパク質を多く含む麦飯優秀説を提唱)。そこで 1884年、白米に大麦を加え、肉やエバミルクを加えるなど食事の中身を若干イギリス風にした。これにより脚気自体はなくなった。しかし、高木はビタミンの存在に気づかず、単にタンパク質が増えたためと考えた。
1896年には、クリスティアーン・エイクマンが滞在先のインドネシアで米ヌカの中に脚気に効く有効成分があると考えた。物質としてビタミンを初めて抽出、発見したのは鈴木梅太郎であった。彼は1910年、米の糠からオリザニンを抽出し論文を発表した。ところが日本語で発表したため世界に広まらなかった。1911年には、カジミール・フンクがエイクマンにより示唆された米ヌカの有効成分を抽出することに成功した。1912年、彼は自分が抽出した成分の中にアミンの性質があったため、「生命のアミン」と言う意味で "vitamine" と名付けた。このとき発見されたのは、ともにビタミンB1(チアミン)である。
1913年エルマー・ヴァーナー・マッカラムは、バターまたは卵黄の脂肪の中にネズミの成長に不可欠な成分があることを発見し、翌年(1914年)その成分の抽出に成功した。マッカラムの抽出した成分は、フンクが抽出した成分と明らかに異なるため、前者を「油溶性A」、後者を「水溶性B」と名付けた。
1920年ジャック・セシル・ドラモンドが柑橘系果物の中の壊血病を予防する成分の抽出に成功した。「生存に不可欠な微量成分」=「ビタミン (vitamine)」の名称は、既に日常的に使用されていたが、これら新発見の成分は明らかにアミン (amine) の化合物ではなかった。そこでドラモンドは、ビタミンの発音はそのままで若干スペルを変更すること (vitamin) を提案し、発見した壊血病を予防する成分を「ビタミンC」と命名した。同時に、前段の「油溶性A」および「水溶性B」もそれぞれ「ビタミンA」、「ビタミンB」と命名されることとなった。以降、vitaminの綴りが定着していくことになる。
その後、生命に必要な成分はいくつか見つかり、その都度、正式な化学構造が判明し適切な名前を付けるまでの仮称として、D, E, F, … と順に名付けられた(ビタミン K を除く)。また、ビタミンBに関しては、非常に似た性質を持つグループがあることが分かり、ビタミンB群として、B1, B2, B3, … と順に名付けられた。
さらにその後、ビタミンFなど、いくつかのビタミンは間違いであることや、ビタミンHなど、B群であることが判明し消滅した。その後、各ビタミンの構造が明らかになり、適切な名称が付けられたが、ビタミンB12(シアノコバラミン)やビタミンC(アスコルビン酸)など、ビタミン名の方が知名度が高いものもある。また、化学構造の解読が早かったり、解読の結果B群に属することが明らかになった結果、仮称(「ビタミン~」)が一般的でないビタミンも存在する(葉酸(ビタミンMもしくはビタミンB9)、ナイアシン(ビタミンB3)など)。2003年にはピロロキノリンキノン (PQQ) が半世紀ぶりに新しいビタミンとして発表されたが、その後ビタミンとははっきりとはいえないとされた。
**注)オリザニン
チアミン(thiamin)は、ビタミンB1とも呼ばれ、ビタミンの中で水溶性ビタミンに分類される生理活性物質。栄養素のひとつ。このほか、サイアミン、アノイリンとも呼ばれる。日本では1910年に鈴木梅太郎がこの物質を米糠から抽出し、アベリ酸と命名。アベリ酸の「酸」たる原因は、実は成分中に入っていたニコチン酸が弱酸性に由来する事が分かり、その成分を除いた純粋な抗脚気効果を持つ成分について、1912年に改めてオリザニンとして発表。糖質および分岐脂肪酸の代謝に用いられ、不足すると脚気や神経炎などの症状を生じる。酵母、豚肉、胚芽、豆類に多く含有される。補酵素形はチアミン二リン酸(TPP)。
有機化学の世界
scienceの部屋
酵素
酵素(enzyme)とは、生体内外で起こる化学反応に対して触媒として機能する分子。酵素によって触媒される反応を「酵素的」反応という。酵素の構造や反応機構を研究する学問領域が、酵素学 (こうそがく、enzymology)。
酵素は生物が物質を消化する段階から吸収・分布・代謝・排泄に至るまでのあらゆる過程(ADME)に関与しており、生体が物質を変化させて利用するのに欠かせない。したがって、酵素は生化学研究における一大分野であり、早い段階から研究対象になっている。
**ADME :薬物動態学および薬理学で用いられる、吸収(Absorption)、分布(Distribution)、代謝(Metabolism)、排泄(Excretion)の英語表記の頭文字からなる略語。
多くの酵素は生体内で作り出されるタンパク質をもとにして構成されている。したがって、生体内での生成や分布の特性、熱やpHによって変性して活性を失う(失活)といった特性などは、ほかのタンパク質と同様である。つまり、酵素はタンパク質そのもの。
生体を機関に例えると、核酸塩基配列が表すゲノムが設計図に相当するのに対して、生体内における酵素は組立て工具に相当する。酵素の特徴である作用する物質(基質)をえり好みする性質(基質特異性)と目的の反応だけを進行させる性質(反応選択性(反応特異性ともいう))などによって、生命維持に必要なさまざまな化学変化を起こさせるのである。ところが今までの無機化学、有機化学では触媒は反応を助ける脇役としてしか取り扱われてこなかった。ところが生命科学では酵素=触媒=タンパク質は生命現象の本質とも言える重要な役割を担っている。複雑多岐に渡る酵素の仕組みの解明無しに生命科学は停滞してしまう。パラダイムの転換が必要らしい。
古来から人類は発酵という形で酵素を利用してきた。今日では、酵素の利用は食品製造だけにとどまらず、化学工業製品の製造や日用品の機能向上、医療など広い分野に応用されている。医療では消化酵素を消化酵素剤として利用したり、疾患により増減する酵素量を検査することで診断に利用。またほとんどの医薬品は酵素作用を調節することで機能しているなど、酵素は医療に深く関わっている。
生体内での酵素の役割は、生命を構成する有機化合物や無機化合物を取り込み、必要な化学反応を引き起こすことにある。生命現象は多くの代謝経路を含み、それぞれの代謝経路は多段階の化学反応からなっている。
細胞内では、その中で起こるさまざまな化学反応を担当する形で多種多様な酵素が働いている。それぞれの酵素は自分の形に合った特定の原料化合物(基質)を外から取り込み、担当する化学反応を触媒し、生成物を外へと放出する。そして再び次の反応のために基質を取り込み、目的の物質を生成し続ける。
ここで放出された生成物は、別の化学反応を担当する酵素の作用を受けて、さらに別の生体物質へと代謝されていく。このような酵素の触媒反応の繰り返しで必要な物質の生成や不必要な物質の分解が進行し、生命活動が維持されていく。
生体内では化学工業のプラントのように基質と生成物の容器が隔てられているわけではなく、さまざまな物質が渾然一体となって存在している。しかし、生命現象を作る代謝経路でいろいろな化合物が無秩序に反応してしまっては生命活動を維持できない。
したがって酵素は、生体内の物質の中から作用するべきものを選び出さなければならない。また、反応で余分なものを作り出してしまうと周囲に悪影響を及ぼしかねないので、ある基質に対して起こす反応は決まっていなければならない。酵素は生体内の化学反応を秩序立てて進めるために、このように高度な基質選択性と反応選択性を持つ。
さらにアロステリズム、阻害などによって化学反応の進行を周りから制御される機構を備えた酵素もある。それらの選択性や制御性を持つことで、酵素は渾然とした細胞内で必要なときに必要な原料を選択し、目的の生成物だけを産生するのである。
このように、細胞よりも小さいスケールで組織的な作用をするのが酵素の役割である。人間が有史以前から利用していた発酵も細胞内外で起こる酵素反応によって行われる。
発見
最初に発見された酵素はジアスターゼ(アミラーゼ)であり、1833年にA・パヤンとJ・F・ペルソ(Jean Francois Persoz)等によるものである。彼らは麦芽の無細胞抽出液によるでんぷんの糖化を発見し、生命(細胞)が存在しなくても、発酵のプロセスの一部が進行することを初めて発見。酵素の命名法の一部である語尾の「-ase」はジアスターゼ (diastase)が由来となっている。
また、1836年にはT・シュワンによって、胃液中からタンパク質分解酵素のペプシンが発見・命名されている。このころの酵素は生体から抽出されたまま、実体不明の因子として分離・発見されている。
19世紀当時、ルイ・パスツールによって、生命は自然発生せず、生命がないところでは発酵(腐敗)現象が起こらないことが示されていた。したがって「有機物は生命の助けを借りなければ作ることができない」とする生気説が広く信じられており、酵素作用が生命から切り離すことができる化学反応(生化学反応)のひとつにすぎないということは画期的な発見であった。
しかし、酵素は生物から抽出するしか方法がなく、微生物と同様に加熱すると失活する性質を持っていたため、その現象は酵素が引き起こしているのか、それとも目に見えない生命(細胞)が混入して引き起こしているのかを区別することは困難であった。
したがって、酵素が生化学反応を起こすという考え方はすぐには受け入れられなかった。当時のヨーロッパの学会では、酵素の存在を否定するパスツールらの生気説派と酵素の存在を認めるユストゥス・フォン・リービッヒらの発酵素説派とに分かれて論争が続いた。生化学反応を起こすと言っても触媒としてだけど。
最終的には、1896年にエドゥアルト・ブフナーが酵母の無細胞抽出物を用いてアルコール発酵を達成したことによって生気説は完全に否定され、酵素の存在が認知された。
鍵と鍵穴説
上述したように、19世紀後半にはまだ酵素は生物から抽出される実体不明の因子と考えられていたが、酵素の性質に関する研究は進んだ。その研究の早い段階で、酵素の特徴として基質特異性と反応特異性が認識されていた。
これを概念モデルとして集大成したのが、1894年にドイツのエミール・フィッシャーが発表した鍵と鍵穴説である。これは、基質の形状と酵素のある部分の形状が鍵と鍵穴の関係にあり、形の似ていない物質は触媒されない、と酵素の特徴を概念的に表した説である。
現在でも酵素の反応素過程のモデルとして十分に通用する。ただし、フィッシャーはこのモデルの実体が何であるかについては科学的な実証を行っていない。
酵素の実体の発見
1926年にジェームズ・サムナーがナタマメウレアーゼの結晶化に成功し、初めて酵素の実体を発見した。サムナーは自らが発見した酵素ウレアーゼはタンパク質であると実験結果とともに提唱したが、当時サムナーが研究後進国の米国で研究していたこともあり、酵素の実体がタンパク質であるという事実はなかなか認められなかった。
その後、タンパク質からなる酵素の存在がジョン・ノースロップとウェンデル・スタンレーによって証明され、酵素の実体がタンパク質であるということが広く認められるようになった。
酵素と分子細胞生物学
20世紀後半になると、X線回折をはじめとした生体分子の分離・分析技術が向上し、生命現象を分子の構造が引き起す機能として理解する分子生物学と、細胞内の現象を細胞小器官の機能とそれに関係する生体分子の挙動として理解する細胞生物学が成立した。これらの学問によってさらに酵素研究が進展する。すなわち、酵素の機能や性質が、酵素や酵素を形成するタンパク質の構造やそのコンホメーション変化によって説明づけられるようになった。
酵素の機能がタンパク質の構造に起因するものであれば、何らかの酵素に適した構造を持つものは酵素としての機能を発現しうると考えることができる。実際に、1986年にはトーマス・チェックらが、タンパク質以外で初めて酵素作用を示す物質(リボザイム)を発見している。
今日においては、この酵素の構造論と機能論に基づいて人工的な触媒作用を持つ超分子(人工酵素)を設計し開発する研究も進められている。
有機化学の世界
scienceの部屋
ホルモン
ホルモン(hormone)は、狭義には生体の外部や内部に起こった情報に対応し、体内において特定の器官で合成・分泌され、血液など体液を通して体内を循環し、別の決まった細胞でその効果を発揮する生理活性物質を指す。ホルモンが伝える情報は生体中の機能を発現させ、恒常性を維持するなど、生物の正常な状態を支え、都合よい状態にする重要な役割を果たす。ただし、ホルモンの作用については未だわかっていない事が多い。焼き肉などのホルモンは語源も異なり、全く別の意味。
ホルモン分子の種類は、生物が進化のどのような段階であるか、また同一の個体でも成長段階によって変わる。数多くのペプチドは無脊椎動物・脊椎動物双方に見られ、構造の相関性を持つものも多い。その他脊椎動物が持つ主なものにはポリペプチド、アミン、カテコールアミン、ステロイドなどがある。つまり、色々な化学物質の総称。
生体内の特定の器官の働きを調節するための情報伝達を担う物質であり、栄養分などとは違って、ホルモンの体液中の濃度は非常に微量であるのが特徴。例えば、低分子量のホルモン血液中の濃度は10−6から10−8 mol/L(nmol/L=ナノモル)、ポリペプチドホルモンで10−9から10−12 mol/L、程度と低濃度。
内分泌系
ホルモンの分泌形式を内分泌系(endocrine system、または液体調整系)と呼ぶ。これは、ホルモンの分泌は体内(体液中)であることから、汗など体外(消化管等の管腔を含む)に分泌される外分泌(exocrine secretion)と対比する呼び方である。ホルモンを分泌する器官を内分泌器官(endocrine organs)と呼ぶ。
ホルモンが生成される部位は数多い。脊髄動物の場合、神経の情報を受けて視床下部・下垂体・副腎髄質などで、細胞の状態から情報を受けて性腺・副腎皮質・甲状腺濾胞細胞・心臓などで、栄養情報から消化管・膵臓・甲状腺濾胞傍細胞・副甲状腺などで作られる。これらのホルモンの貯蔵方式も様々である。ペプチドホルモンやアミンホルモンは分泌顆粒の中に蓄えられ、甲状腺が分泌するホルモンはタンパク質の形で維持される。これらに対しステロイドホルモンでは貯蔵例が発見されていない。分泌されたホルモンは体液を通じて運ばれるが、甲状腺ホルモンはある種のタンパク質と結合した状態で輸送される。
ホルモンが作用を発揮する器官をホルモンの標的器官(target organ)、実際に作用を起こす細胞をホルモン標的細胞(target cell)と呼ぶ。ここには、ホルモン分子に特異的に結合する蛋白質であるホルモン受容体(ホルモン・レセプター)が存在する。受容体がホルモンと結合することが、その器官でホルモンの作用が発揮される第一のステップとなる。標的器官が非常に低濃度のホルモンに鋭敏に反応するのは、このホルモン受容体蛋白質が、ホルモン分子とだけ強く結合する性質が基本となっている。
アミンやペプチドホルモンといった水溶性ホルモンは細胞膜上の受容体(レセプター)で受容され、細胞膜の構造や機能を変化させたり、生成させた第二メッセンジャーを細胞内部に浸透させて働きを起こす。甲状腺ホルモンやステロイドホルモンといった脂溶性ホルモンはそのまま細胞膜を通過することができ、細胞内(核内)に存在する受容体と結合することにより複合体となって遺伝子情報に制御を加える働きを持ち、特定遺伝子の活動を活発にしたり、伝令RNAの生成を促したりする。甲状腺ホルモンは細胞膜やミトコンドリア上にも結合する部位が見つかっているが、その機能は明らかになっていない。
ホルモンによって行われる、ある器官の機能の調節のことを、体液循環を介した調節であることから液性調節と呼ぶ。液性調節は、神経伝達物質を介した神経性調節に比べて、時空間的には厳密なコントロールができない一方、遠く離れた器官に大きな影響を与えることができる、コストのかからない調節であるといえる。また、アドレナリンなど液性調節と神経性調節の両方でシグナル伝達に介在する物質もある。ただしホルモンは神経伝達物質などと物質が共通しているものが多く、また神経伝達物質も必ずしもシナプス内だけで働くものではない。そのため、神経伝達物質や細胞増殖因子とホルモンを特に区別しない場合もある。実際に、ホルモンは他の情報系や標的細胞の様々な要因と密接に関連しながら作用を及ぼす。
ホルモンの検出と測定法
ホルモンは、非常に微量でその作用を発揮するようにできており、血液などの体液中での濃度も極めて低い。そのため、ホルモンを、その物質としての性状から他の物質と分離・精製するのは一般に困難である。しかし、ホルモンの濃度を調べることは、特定の病気の診断において、非常に重要な場合がある。
生理活性を利用した手法
ホルモンの生体内での生理活性を指標にする方法。ホルモンの濃度の国際単位はこの方法で決定されている。実験動物などにホルモンを投与し、その動物に起きる反応の大きさを、あらかじめ濃度のわかっているホルモン試料と比較することで、濃度を推定する。実験動物を用いた方法に加え、特定の培養細胞を用いた方法も開発され、基準化および簡便化が図られている。
免疫学的な手法
ホルモンに対して特異的に結合する抗体を測定対象の試料に加え、ホルモンと抗体との複合体を形成させ、このホルモンと結合した抗体の量を何らかの方法で測定する方法。生理活性を用いた方法よりも簡便で安価であり、実際の診療に用いられる場合が多い。
有機化学の世界
scienceの部屋
ATPとADP



ATPは体内代謝のエネルギー通貨と言う説明がされている。ATPとADPがぐるぐる回っているでは、どこからエネルギーが得られるかの説明になっていない。
上の写真は右端はATPの粉末。これを溶かして鳥の筋繊維につけると筋繊維が収縮する。
アデノシン二リン酸(Adenosine diphosphate、略:ADP )は、アデニン、リボース、および二つのリン酸分子からなる化学物質。リン酸は高エネルギーリン酸結合をとっており、ATP から ADP とリン酸基に分かれる際に放出されるエネルギーは生体内での主要なエネルギー源となっている。アデニル酸(AMP)とATPからアデニル酸キナーゼによって生成される。
アデニル酸
アデニル酸(アデニルさん、adenylic acid)は別称をアデノシン一リン酸(Adenosine monophosphate)ともいう有機化合物で、RNA中に見られるヌクレオチドの一種である。AMPと略される。AMPは核酸塩基のアデニン、五炭糖のリボース、1つのリン酸より構成されており、リン酸とアデノシン(ヌクレオシド)の間でリン酸エステルを形成している。リン酸部位の結合位置により 2'-体、3'-体、5'-体の構造異性体があるが、RNA中に部品として見られるのは 5'-アデニル酸 である。
有機化学の世界
scienceの部屋
パラジウム

パラジウム(palladium):原子番号46。元素記号は Pd。白金族元素の1つ。貴金属にも分類される。因みに白金はPt。
常温、常圧で安定な結晶構造は、面心立方構造 (fcc)。銀白色の金属(遷移金属)で、比重は12.0、融点は1555 °C。酸化力のある酸(硝酸など)には溶ける。希少金属の1つ。
自分の体積の935倍もの水素を吸収するため、水素吸蔵合金として利用される。加工のしやすさから電子部品の材料としても使われたが、供給シェアの6割をロシアに依存しており、価格が不安定なことからニッケルなどの金属への代替が進められている。
特筆すべきは歯科治療(インレー)に使われる合金としての利用が挙げられる。いわゆる銀歯は金銀パラジウム合金で、20%以上のパラジウムを含有する。
| 日時 | 金 | プラチナ | パラジウム | 銀 |
| 2021/2/26 | 6,103 | 4,213 | 8,300 | 100 |
| 2021/3/1 | 6,019 | 4,191 | 8,175 | 98 |
| 2021/3/2 | 5,982 | 4,173 | 8,270 | 98 |
これら4つの貴金属は、価格の変動が大きい。上の価格はg当たりだろう。今は、金価格が値上がりしており、パラジウムはそれ以上。ロシアに対して米国が経済制裁何てやらかしたらどうなることやら。1kgのインゴットでで830万円とはかなり高価な金属だ。
化学の世界
有機化学の世界
scienceの部屋
琥珀
 琥珀(こはく)またはコハク(Amber、アンバー)は、天然樹脂の化石であり、宝石。半化石の琥珀はコーパル(Copal)、加熱圧縮成形した再生コハクはアンブロイド(ambroid)という。鉱物に匹敵する(*つまり琥珀は化石であって鉱物とは言わない)硬度を持ち、色は飴色、黄色を帯びた茶色ないし黄金色に近い。
琥珀(こはく)またはコハク(Amber、アンバー)は、天然樹脂の化石であり、宝石。半化石の琥珀はコーパル(Copal)、加熱圧縮成形した再生コハクはアンブロイド(ambroid)という。鉱物に匹敵する(*つまり琥珀は化石であって鉱物とは言わない)硬度を持ち、色は飴色、黄色を帯びた茶色ないし黄金色に近い。
**コーパル(Copal):
コーパルは木の樹脂に付けられた名前で、特にコロンブス以前のメソアメリカの文化で儀式的に燃やされた香や他の目的で使用されたコーパルの木、プロチウムコーパルからの芳香族樹脂。より一般的には、コパールという用語は、「粘着性のある」樹脂と琥珀の間の重合および硬化の中間段階にある樹脂状物質を表す。未成熟の琥珀ということか。
琥珀は純物質ではないが、主成分は高分子のイソプレノイド。これは、樹液に含まれるテルペンが天然樹脂やその化石となる過程の高温・高圧の下で、酸化、蒸発、重合などの化学変化を起こし、その結果として生じた重合体。樹液が固まっただけでは琥珀は出来ない?
200℃以上に加熱すると、油状の琥珀油に分解され、さらに加熱を続けると黒色の残留物である「琥珀ヤニ、琥珀ピッチ」という液体になる。琥珀は燃えるものということだろう。
名称:「琥」の文字は、中国において虎が死後に石になったものだと信じられていたことに由来。日本の産地である岩手県久慈市の方言では、「くんのこ(薫陸香)」と呼ばれる。
英名 amber はアラビア語: عنبر (ʿanbar、龍涎香のような香りがするもの)に由来する。
**龍涎香:
龍涎香あるいはアンバーグリスは、マッコウクジラの腸内に発生する結石。香料の一種。 生成されたばかりの龍涎香は、海の匂いや糞便臭がする。熟成するにつれて、甘い、土の香りを獲得し、一般的には、蒸気質の化学的渋みのない、消毒用アルコールの香りに例えられる。
もっとも古い琥珀は、上部石炭紀の地層の物とされている。琥珀を擦ると布などを吸い寄せる摩擦帯電の性質を持つことは今日では有名であるが、歴史上最初に琥珀の摩擦帯電に言及をしたとされている人物は、紀元前7世紀のギリシャ人哲学者タレスとされている。
古代ギリシアではエーレクトロン(古希: ἤλεκτρον)と呼ばれる。意味は「太陽の輝き」という意味である。エレクトロン? そう、英語で電気を意味する electricity は琥珀を擦ると静電気を生じることに由来しているのです。ドイツ語の琥珀、ベルンシュタイン(Bernstein)は「燃える石」の意で、琥珀を指す。これは可燃性である石であることから名づけられた。
琥珀の利用
装身具に利用される。人類における利用は旧石器時代にまで遡り、真珠や翡翠と並び「人類が最初に使用した宝石」とも言われる。しかし、ロシアの琥珀で宝飾品に使われるのは三割程度と言われ、宝飾品にならない物は工業用として成分を抽出して使われる。薬としても利用されたようだ。ポーランドのグダンスク地方では琥珀を酒に浸し、琥珀を取り出して飲んでいる。
 古生物学
古生物学
樹脂の粘性に囚われた小生物(ハエ、アリ、クモ、トカゲなど)や、毛や羽、植物の葉、古代の水や空気(気泡)が混入していることがある。特に虫を内包したものを一般に「虫入り琥珀」と呼ぶ。昆虫やクモ類などは、通常の化石と比較すると、はるかにきれいに保存されることから、化石資料としてきわめて有用である。
小説『ジュラシックパーク』のフィクションの設定は、琥珀内の蚊から恐竜の血とDNAを取り出して復元するというもので、作品発表当時のバイオテクノロジーでは、実際にシロアリで実験出来たとか。ただし、数千万年前ともなると琥珀に閉じ込められた生体片のDNAを復元することは実際には不可能とされている。
市販の「虫入り琥珀」については、偽物も多いので気を付けないといけない。年代の浅いコーパルをあえて琥珀の名称で売っているもの(これは一応本物と言えるか?)、コーパルなどを溶解させ現生の昆虫の死骸などを封入した模造品、樹脂でなくプラスチックなどで作った偽物、など。
産地だけなら世界中にある。質と量が充実しているのはバルト海沿岸地域とドミニカ共和国。バルト海沿岸を中心に、琥珀の交易路が整備され、この交易路は琥珀の道(琥珀街道)という名称が付けられた。アジアでは中国やミャンマーも有名。
日本では岩手県久慈市で、質は良く、量は世界スケールで見れば少ない。他に福島県いわき市や千葉県銚子市などで産出される。久慈の地層は白亜紀後期のもので、琥珀は樹脂を出す樹林が繁茂していた証拠である。最近、恐竜化石の産出で新たに注目を浴びている。
久慈市は世界有数の琥珀産地です。当地域の琥珀は、まだ恐竜が地上にいた約9千万年前のもので、宝飾品などに使われている琥珀としては世界でも古い年代のものです。あめ色に輝く琥珀は、地上に繁茂していた樹木の樹脂が土砂などに埋もれ化石化したもので、いわば「樹脂の化石」。 また、久慈市には国内唯一の琥珀博物館があり、自然・文化・アートとさまざまな側面から、見て・触れて・体験して「琥珀」を知ることができます。(久慈市)
王立協会が発行した論文によれば、ヨーロッパ北部にある新生代・古第三紀の森林から、バルト地域に105トンの琥珀が作られたという。これはこれまで知られている単一の埋蔵量としては最大のものである。バルティック・アンバーとして知られるバルト地域産の琥珀は品質も高く、いつの時代の昆虫の化石も非常に優れた保存状態を保っている。これと比べ久慈の琥珀は中生代・白亜紀後期のものでより古い。古生代石炭紀の琥珀は見つかっているのでしょうか? つまり、石炭紀の植物は樹脂を分泌できたのかどうかということです。
石炭と言えば、石炭層に琥珀が発見されることも多いとか。成因を考えればどちらも樹木の化石だから、ある意味当然かもしれないけど。
有機化学の世界
scienceの部屋
細胞とは何か
人の体は60兆個(6×1013個)の細胞からなっていると言われます。総ての生物は、細胞から出来ています。細胞とは、一言で言うと外界と遮断された小さな、小さな袋です。生命活動とは、この袋を維持し、さらに増殖していくことです。そのためには外界とのエネルギーや物質のやり取りが不可欠です。細胞説という生物学の基本的な前提があります。重要な教義は次の3つ。ユークリッド幾何学の公準みたいなものですか。
1.細胞は生命の基本単位である。
2.総ての生命体は細胞から構成される。
3.総ての細胞は既に存在している細胞から生じる。
この前提を認めましょう。すると、まず始めにでは、細胞とは何かに答えなければなりません。例えば、ウィルスは細胞ではないので生物と呼ばないのでしょう。ウィルスは自己増殖するので3は満足していますが。ところで3に関しては、では最初の細胞は。生命の起源の謎は残されたままです。
ところで、細胞はどうして小さいのでしょうか。それは、細胞という袋の容積と表面積の関係にあります。つまり、
1.細胞の容積は、細胞が単位時間当たりに行う化学反応の量を決定する。
2.細胞の表面積は、細胞が外部環境から取りこむ物質の量と外部環境へ排出する老廃物の量を決定する。
例えば、細胞を球とすると、容積は(4/3)πr3、表面積は4πr2、その比は1/3rとなる。rは物質の移動距離に比例するでしょう。
つまり、細胞は基本機能が満足される限りできるだけ小さい方が良いことになる。ほとんどの細胞は1~100μm。光学顕微鏡で見える範囲です。
生物学者は、総ての生物を3つに分類する。古細菌、真正細菌、真核生物である。古細菌と真正細菌はまとめて原核生物と呼ばれる。進化の上では、最初の細胞が古細菌と真正細菌の分化し、その後真正細菌から真核生物が進化したものと想定されている。
真核生物の細胞は、細胞の中にさらに膜で囲まれた幾つかの細胞内コンパートメントを持っていること。細胞の中に別の細胞がある入れ子構造とことでしょうか。このコンパートメントの一つが核と呼ばれるもので、遺伝物質(DNA)を持っている。それぞれのコンパートメントの中では、それぞれ特異な化学反応が進行する。真核生物には、原生動物、菌類(真菌類)、植物、動物と我々が普段生物として認識しているほとんどの生物が含まれています。ここまで見て来ると、生命の起源を探る旅は、まず原核生物の実態を知らねばならないようです。
【真核生物の発生】
最初の原核生物は多分環境から養分を体の表面から直接取り込んでいたのだろうと想定されています。海中には栄養塩がたくさん溶けていて特に食物を食べる必要もなかった平和な世界だったのでしょう。最古の原核生物は、化石から35億年前には現れたものと推定されています。地球が生まれたのが46億年前。生命誕生まで10億年以上要したわけです。最初の真核生物が登場するのが15億年まえからですから、20億年間は原核生物だけの世界が続いていたわけです。そのうち海水中の養分が不足してきたためか、原核生物のあるものは光合成を始めるようになります。この時から地球大気にはどんどん酸素が蓄積されるようになります。また、ある原核細胞は別の原核細胞を飲み込むことで栄養を摂取するようになります。飲み込まれた細胞が消化されずに、中に閉じ込められ、細胞内での共生を行うようになったと考えられています。細胞内の細胞が特別な役割を分担して、宿主も下宿人のともに利益を得るというより進化した細胞が出来上がったわけです。
光合成原核生物から今の植物の葉緑体が生まれたのだろうと推測されています。また、ミトコンドリアも大きな原核細胞に飲み込まれた呼吸機能を持った原核細胞から進化したものと推定されています。ちょうどそのころ増加した大気中の酸素の毒性を消去してくれるため、進化上非常に有利に働いたはずです。因みに、葉緑体もミトコンドリアも体内に独自のDNAを持っており、もともと独立した原核細胞であったことが示唆されています。この考えを細胞内共生説と言い、今ではかなり多くの研究者に支持されています。
有機化学の世界
scienceの部屋
水は特別な存在
水は、我々の生活のいたる所に存在していますが、水分子は極めて特異な化合物でもあることも知っておかねばなりません。
1.分子サイズから見て異常に高い沸点。
2.分子サイズから見て異常に高い融点。
3. 分子サイズから見て異常に大きい蒸発熱。
4. 分子サイズから見て異常に大きい融解熱。
5.きわめて大きな比熱。
6.固体になる時体積が大きくなることがあるのは水だけ。
7.色々な物質を溶かすことができる。
8.水素結合と特別な構造を取ることができる。

ほかの液体と比べ、何から何まで非常に特別なのです。その秘密は、水分子の水素結合という独特の形に起因しているとされていますが、まだ完全に解明されたわけではないそうです。まず、沸点を見ます。水の分子は、ちょうど正4面体の2つの頂点に水素ついています。ちょうどメタンの分子と良く似た形です。メタンは炭素原子にちょうど対称に水素原子が4つついた形です。炭素の原子は結合の手が4本ある、第14族に属する原子です。周期律表では、下に向かって炭素C、珪素Si、ゲルマニウムGe、錫Sn(すず)と続きます。立体的な対称性から、H-C-Hの角度は109.28度ですが、H-O-Hも角度が105度と少し小さいながら近い値となっています。これら14族系の分子の融点をみると、分子が重くなるほど融点が高くなっています。これらは常温では気体で液体にするには相当に冷やす必要がある訳です。いずれにしろ分子量18の水が常温で液体であること自体、大変不思議なことなのです。
なお、常温で液体の元素は臭素Br(融点-7.2℃)と水銀Hg(-38.83)の二つだけ。もう少し高温まで考えると、フランシウム、セシウム、ガリウム、ルビジウムなどあるが。臭素はハロゲン族(17族)でフッ素、塩素、臭素、ヨウ素となりますが、軽いFとClは気体、重い要素は固体です。一般に14から17族の元素の水素化合物は、族毎に比較すると、分子量が大きくなるほど、沸点、融点が高くなる傾向がある。ただし、第二周期の値が若干異なるのが気になる。まずは、17族フッ化水素の沸点、融点が異常に高い。16、15族の水、アンモニアも沸点、融点が異常に高い。これも水素の水素結合のせいであります。
次に、物質の比熱を比べて見る。単位はJ/g・K。
水…4.217、氷…2.10、ポリエチレン…2.23、ガラス…0.67、鉄…0.435、銅…0.379、銀…0.235、鉛…0.129。
色々並べたが、どうも水の比熱はダントツに大きいようだ。因みに気体の比熱は、気体の種類が異なれば異なる値になりますが、モル比熱というものを使うと次のように簡単に比較できるようになります。モル比熱に直すには、1gの気体の比熱に分子量をかければで出来ます。
すなわち、
単原子分子
ヘリウムのモル比熱:5.3232×4=20.928 J/mol・K
アルゴンのモル比熱: 0.523×40=20.92 J/mol・K
2原子分子
水素のモル比熱: 14.385×2=28.716 〃
窒素のモル比熱: 1.034×28=28.95 〃
酸素のモル比熱: 0.922×32=29.502 〃
塩化水素のモル比熱:0.812×36=29.232 〃
3原子分子
水蒸気のモル比熱: 2.051×18=36.918 〃
二酸化炭素のモル比熱:0.837×44=36.826 〃
それ以上
メタンガスのモル比熱:2.210×16=35.36 〃
理想気体のモル比熱は、気体定数8.317 J/mol・Kに対して単原子分子、2原子分子、3原子分子でそれぞれ、(5/2)、(7/2)、(9/2)倍、すなわち20.79、29.11、37.46に近い値となっています。 固体の場合もモル比熱で表すと、
水のモル比熱: 4.217×18=75.91 J/mol・K
氷のモル比熱: 2.10×18=37.8 J/mol・K
鉄のモル比熱: 0.435×55.85=24.3 J/mol・K
化学結合には、共有結合、イオン結合、金属結合、配位結合などがありますが、これらと比べて力はやや弱いのですが水素結合といる水分子や一部の水素を含む小分子にみられる水素結合というものがあります。詳細については少し勉強してから紹介したいと考えています。
ここでは、この水分子の特異性が、地球の歴史、生物の歴史に大きな役割を果たしてきたことについて述べて見たい。地球誕生の時点では、地球は毎日隕石が降り注ぐマグマオーシャンともいうべきドロドロの火の玉の溶岩の海のようだとも言われています。やがて地球が冷えて地殻から水が絞り出されて、大気中で凝結して雨となって地表を急激に冷やしていきます。この冷却には水が大きな蒸発熱を奪うことも幸いしています。このようにして海が誕生して、海からの水分蒸発→大気中の凝結→降水のサイクルが出来たことがその後の地球システムの安定化に大いに寄与します。
また、海水はまた色々な栄養成分を溶かすことが出来るので生物の発生の準備を行うことが出来ました。生命を造るもとになる分子(アミノ酸や脂肪)には、たいてい親水性の部分と疎水性の部分を両端に持っており、自然と細胞のように一つの丸まった形の膜をつくるようになり、原始細胞が生まれます。これも水素結合を利用していると言われます。
多細胞生物が発生するまでは、地球が全球凍結となったことが3度ほどあったことが知られていますが、氷が水よりも軽いと性質からか、海の中に凍っていない海水が残っている場所が確保されていて、いくらかの生物が生き残ることが出来たのだと想定されています。
その後も地球環境に対して水の果たした役割は計り知れないでしょう。
scienceの部屋
珪素と硫黄の世界
元素の周期律表を確認して頂きたい。14族~16族、炭素Cの下に珪素Si、窒素Nの下に燐P、酸素Oの下に硫黄Sが位置している。これらは化学的に良く似た性質を持つことが知られています。ただし、原子の大きさから上のものほど沸点が高く気体になり易く、下に行くと液体、固体と変わっていきます。
まず、炭素と珪素を比べ見ます。炭素は有機化合物を造ります。結合の手を4本持って、糖、タンパク質、脂肪の他、生命を構成するための元素です。珪素も同じような性質があるはず。昔はSFでは、炭素の代わりに珪素を主体とする生命体なども考えられていました。どうもその可能性は無いようですが。その代り、地球の岩石には大量の珪素が含まれています。SiO2は固体ですが、CO2は気体。この差が大きいですね。珪素は英語でsilicon。コンピュータのチップの重要な原料は、珪素が主体。人工頭脳は人間の脳を追い越してしまう可能性もあります。珪素が炭素に勝利するということですかね。
次に酸素と硫黄。H2Oは水ですが、H2Sは硫化水素。地球の歴史で、最初は地表には、酸素がありませんでした。酸素は化学反応をしやすいため、単体では存在できないようです。地球以外の太陽系の惑星で大気に酸素が含まれているものはありません。だから、初期の生命は酸素を利用できないので、代わりの硫黄を使っていたと考えられています。シアノバクテリアが誕生してからも、数億年は硫黄を使う細菌達の天下だったと考えられています。硫黄を利用する細菌は今でも、深海の熱水鉱床の近くとか温泉とかで生き続けいます。シアノバクテリアが光合成を行い酸素を発生するようになって、現在の真核細胞の生物が現れるようになります。でも、最初の生命の誕生には硫黄が不可欠だったのかも知れません。硫黄を利用する細菌達、地球環境が悪化してほとんどの生物が絶滅した後、自分たちの天下がまた来るものとひたすら待ち続けているのかも知れませんね。
似た元素どうしでもずいぶん働きが違いますね。NとP、NaとKなども比べて見ると面白いかも。
scienceの部屋
窒素とリンの役割
生物の細胞を構成するには、窒素NとリンPが非常に大切だ。人の体はタンパク質からできている。たいていの細胞もそうだ。蛋白質には窒素が不可欠だ。つまり、タンパク質はアミノ酸が連なったもの。アミノ酸を作るアミノ基とは―NH2でアンモニアから水素原子が取れたもの。
一方、DNAの情報からアミノ酸の配列が決まる。また、DNAはデオキシリボ核酸という化学物質です。長く紐(ひも)状につながって染色体という構造を作り上げています。この核酸を作るのに必要なのがリンです。また、生物がエネルギーを得るために使うのが、ATPとかADT、アデノシン三(二)リン酸で、ここでもリン(リン酸)が大活躍。
栄養学では、三大栄養素として炭水化物、脂肪、タンパク質があげられていますが、この中で、窒素が入っているのはタンパク質だけ。リンはどのように体に取り入れるのでしょうか。また、必須アミノ酸は体内で合成できないらしいので、タンパク質の摂取必要量もここのアミノ酸毎に計算しないと意味がないように思うのですが。
また、植物は光合成で自分の栄養を作ると言われていますが、光合成で作られるのは澱粉(でんぷん)などの炭水化物、ここから窒素やリンを使って、核酸とアミノ酸を合成できないと細胞を作ることはできないはずです。核酸とアミノ酸こそ生命の源。窒素とリンの循環にも目を向けていく必要がありそうです。
scienceの部屋
光合成
光合成とは本当は大変難しい反応のようです。未だに大量の海水と太陽光で人工光合成を行うことは実現していません。でも、生物の生きる力は総て化学反応で説明できるはずなんです。
まず、水が分解されて水素(H2)と酸素(O2)が出来ます。水が分解するにはエネルギーが要りますが、太陽光を利用するのが光合成。初期の生命は他の化学エネルギーを使っていたようです。また、初期の生命は水の代りに硫化水素(H2S)も使っていたようです。酸素も硫黄も周期律表では同じ族で最外核電子は伴に6個で同じような化学的性質があります。
でも、エネルギーを貰って水素を還元して、出来た水素を酸化(硫黄と化合することも酸化)してエネルギーを得る。これが基本の反応なのか。
水素原子の還元力(エネルギー)は、二酸化炭素の固定に使われということらしいです。炭素は生命体を構成する主要な元素。二酸化炭素から有機物が合成されるようですが、光合成では副産物として酸素が発生するということで、これが原始の生命達にとっては大変有毒だったらしい。では、酸素を発生しない水素原子の還元力の利用方法は無かったのかといえば、原始の生命はそのようにしてエネルギーを利用していたらしいことも分かっています。
光合成として、水と二酸化炭素からブドウ糖が造られると仮定すれば、
6CO2+6H2O→C6H12O6+6O2 (1)
のように書くことが出来、
水素に変わって炭素(C)が還元されたことに。ブドウ糖をエネルギーとして燃やせば、
C6H12O6+6O2→6CO2+6H2O (2)
(1)と(2)は反応の向きが反対なだけなので、(1)ではエネルギーを外界からもらい、(2)ではエネルギーを放出することに。(1)と(2)を見れば分かる通り、水素の酸化数は変化しておらず、(1)では炭素が還元(C:6×(+4)→6×0)されており、(2)では炭素が酸化されています。
化学合成とは、硝酸菌・硫黄細菌・メタン細菌などが、無機物を酸化・還元して得られるエネルギーによって炭酸同化を行います。 光エネルギーを用いる光合成に対して使われます。でも、地球上で最初に出来た生命は皆化学合成でエネルギーを得ていたことが分かっています。古細菌(アーケア)と呼ばれる生物群は、全く酸素のない環境で生きていたはずで、還元剤に水を使わず、硫化水素などの他の分子を使っていたものと想定される。
scienceの部屋
数学の部屋
目次
| 幾何学再入門 | 正四面体の重心と頂点のなす角度 | ベクトル解析入門 | 部分積分と置換積分 |
| ベイズ統計にチャレンジ |
幾何学再入門
幾何学と言えば、総ての学問の基礎というのが欧米での常識。我が国では最近あまり人気がない。化学のおける立体構造や鉱物の結晶学等、空間図形は結構ややこしい。本当はユークリッド幾何の初歩からやればよいのでしょうが、それはそのうちにKids Roomの方で展開したいと思ってます。
正四面体の重心と頂点のなす角度
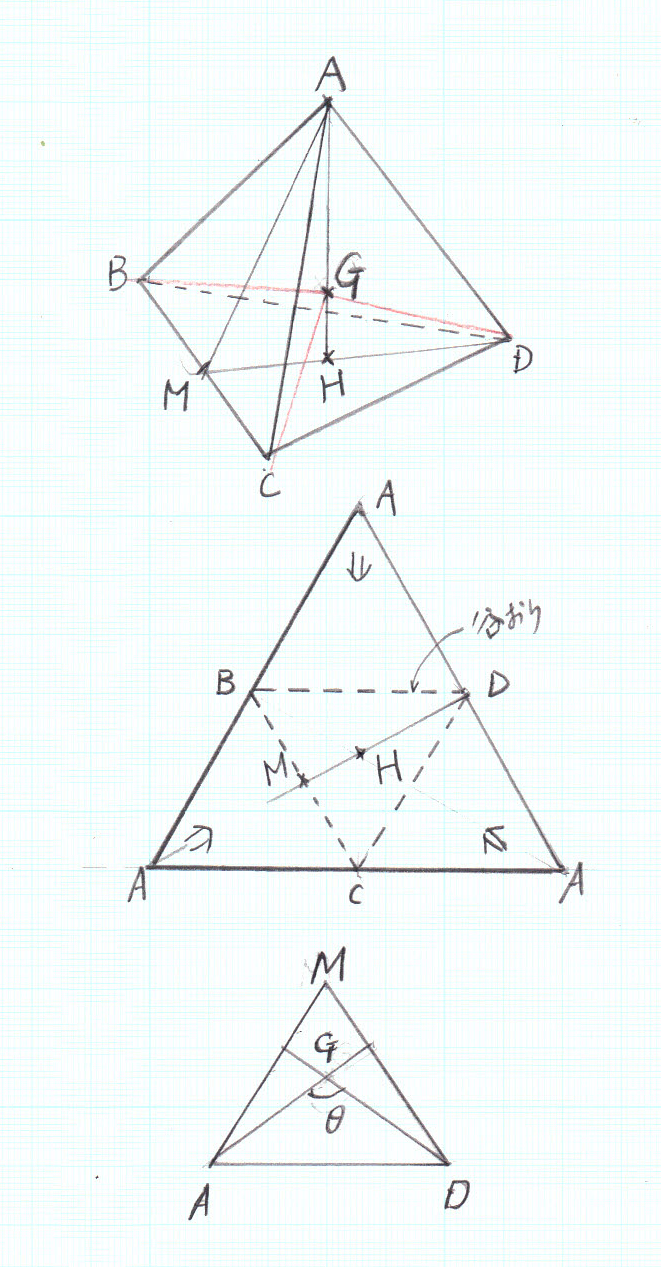 メタンCH4の立体構造は、真ん中に炭素、正四面体の4つの頂点に水素分子が結合。H―C―Hのなす角度は109.5度となっています。この角度は正四面体の基本的な性質で、化学の問題でなく、自分で計算できる必要があります(化学の教科書には書いていない)。この計算は高1レベルでしょうが、立体図形でもあり結構考えにくいと思います。
メタンCH4の立体構造は、真ん中に炭素、正四面体の4つの頂点に水素分子が結合。H―C―Hのなす角度は109.5度となっています。この角度は正四面体の基本的な性質で、化学の問題でなく、自分で計算できる必要があります(化学の教科書には書いていない)。この計算は高1レベルでしょうが、立体図形でもあり結構考えにくいと思います。
まず、正四面体の重心をG、4つの頂点をA、B、C、Dとします。図を参考にしてください。下図は上の立体の展開図です。正三角形が4つ集まっています。3つのAが折り返しで一つになります。正三角形の一辺をaとします。
さて、BCの中点をMとします。
AM=DM=(√3/2)a
Hを△BCDの重心とすると、DH=(2/3)DM=(2/3)×(√3/2)a=(√3/3)a
AH=√(AD2-DH2)a=√(1-(√3/3)2)a=√6/3a
ここで、重心Gは、AH上にあって、錐体(四面体)の重心であるから、AG:AH=3:4
よって、AG=(3/4)AH=3/4×√6/3a=√6/4a=0.6123a=(1/1.633)a
ここで、△MADを考えると、AG=DG
求めたい角度∠AGD=θとして、余弦定理を適用する。
2AG・DGcosθ=AG2+DG2-AD2
2×(√6/4)a×(√6/4)a cosθ=(√6/4)2a2+(√6/4)2a2-a2
∴cosθ=-1/3
ここからは、関数電卓の出番で、cos-1θ=arccosθ=1.9106 rad=109.47°として求めることが出来る。
ここで、錐体の重心位置および体積の求め方をレビューする。


錐体(底面積S)と三角形(底辺b)の比較をしてみると良く似た関係がある。
| 図形 | 体積 | 重心位置 |
|---|---|---|
| 錐体 | (1/3)Sh | (3/4)h |
| 三角形 | (1/2)bh | (2/3)h |